El agua es esencial para la supervivencia de todas las formas conocidas de vida.
El término agua generalmente se refiere a la sustancia en su estado líquido, aunque la misma puede hallarse en su forma sólida llamada hielo, y en su forma gaseosa denominada vapor.
PROPIEDADES:
- Simplicidad en su estructura molecular.
- Constituida por dos átomos de hidrógenos y un átomo de oxígeno.
- Es polar, con una densidad de carga negativa sobre el oxígeno y una positiva sobre el hidrógeno.
 Esta propiedad es la responsable de la capacidad solvente del agua. Es decir, los compuestos iónicos y los compuestos con distribución heterogénea de la carga se disuelven por la atracción de densidades opuestas en signo. A estas moléculas se las denomina moléculas hidrofílicas (afinidad por el agua).
Esta propiedad es la responsable de la capacidad solvente del agua. Es decir, los compuestos iónicos y los compuestos con distribución heterogénea de la carga se disuelven por la atracción de densidades opuestas en signo. A estas moléculas se las denomina moléculas hidrofílicas (afinidad por el agua). Por el contrario, moléculas sin carga o sin densidad electrónica neta son insolubles en agua, pues las uniones agua - agua son mas fuertes que las agua - compuesto y entonces el compuesto es excluido por las moléculas de agua.
A estos papeles centrales en la determinación de la función y estructura de grandes moléculas, siendo fundamental como medio donde ha prosperado la vida.
La Química del Agua
La polaridad del agua
| El agua tiene una estructura molecular simple. Está compuesta por un átomo de oxígeno y dos de hidrógeno. Cada átomo de hidrógeno se encuentra unido covalentemente al oxígeno por medio de un par de electrones de enlace. El oxígeno tiene además dos pares de electrones no enlazantes. De esta manera existen cuatro pares de electrones rodeando al átomo de oxígeno: dos pares formando parte de los enlaces covalentes con los átomos de hidrógeno y dos pares no compartidos en el lado opuesto. El oxígeno es un átomo electronegativo o "amante" de los electrones, a diferencia del hidrógeno. El agua es una molécula "polar"; es decir, existe en ella una distribución irregular de la densidad electrónica. Por esta razón, el agua posee una carga parcial negativa (  ) cerca del átomo de oxígeno y una carga parcial positiva (+) cerca de los átomos de hidrógeno. ) cerca del átomo de oxígeno y una carga parcial positiva (+) cerca de los átomos de hidrógeno.Una atracción electrostática entre la carga parcial positiva cercana a los átomos de hidrógeno y la carga parcial negativa cercana al oxígeno da lugar a un enlace por puente de hidrógeno. |
| La habilidad de los iones y otras moléculas para disolverse en el agua es debida a la polaridad de ésta última. Por ejemplo, en la imagen inferior se muestra el cloruro sódico en su forma cristalina y disuelto en agua. |
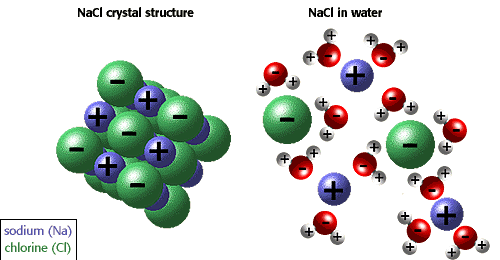 Muchas otras propiedades únicas del agua son debidas a los puentes de hidrógeno. Por ejemplo, el hielo flota porque los puentes de hidrógeno mantienen a las moléculas de agua más separadas en el agua sólida que en el agua líquida, donde hay un enlace de hidrógeno menos por cada molécula.
Muchas otras propiedades únicas del agua son debidas a los puentes de hidrógeno. Por ejemplo, el hielo flota porque los puentes de hidrógeno mantienen a las moléculas de agua más separadas en el agua sólida que en el agua líquida, donde hay un enlace de hidrógeno menos por cada molécula.Las propiedades físicas únicas, incluyendo un alto calor de vaporización, una fuerte tensión superficial, un calor específico alto y el hecho de ser casi el disolvente universal, también son debidas a la polaridad del agua y a su capacidad de formar enlaces por puentes de hidrógeno.
El efecto hidrofóbico, o la exclusión de compuestos que contienen carbono e hidrógeno (sustancias no polares) es otra de las propiedades únicas del agua causadas por los enlaces de hidrógeno.
El efecto hidrofóbico es particularmente importante en la formación de membranas celulares. La mejor descripción que puede darse de este efecto es que el agua "arrincona" a las moléculas no polares, manteniéndolas juntas.
Ácidos y Bases, Ionización del Agua
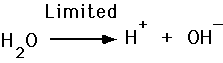
- Los ácidos ceden H+.
- Las bases aceptan H+.
Se define el pH de una disolución como el logaritmo negativo de la concentración de iones de hidrógeno.
- A pH 7.0 la disolución es neutra.
- A un pH menor (1-6) la disolución es ácida.
- A un pH mayor (8-14) la disolución es básica.

No hay comentarios:
Publicar un comentario
¡Bienvenidos!